Спаренный электрон - это электрон, который находится в одной орбитальной оболочке с другим электроном. Они обладают противоположным спином и равным, но противоположным зарядом. Такая конфигурация электронов является очень стабильной и важной для химических реакций.
Когда электроны спарены, это означает, что они располагаются в одной орбитали и занимают противоположные направления в пространстве. Такая конфигурация облегчает ионизацию или передачу электрона, так как спаренные электроны имеют большую энергию и меньшую склонность к реакциям.
Значение спаренных электронов в химии заключается в их участии в образовании химических связей. Спаренные электроны могут быть общими для двух атомов, создавая ковалентную связь. Это позволяет атомам обменивать электроны и образовывать молекулы, совместно удерживающие их вещества.
Важно отметить, что спаренные электроны обладают высокой энергией и могут быть участниками химических реакций. Их наличие и уровень энергии влияют на стабильность и химические свойства вещества. Также спаренные электроны могут быть основой для образования химических связей и определять структуру молекулы.
В заключение, спаренные электроны являются важным концептом в химии. Они обладают особым распределением энергии и заряда, что позволяет им играть роль в образовании связей и в реакциях между атомами и молекулами. Понимание спаренных электронов помогает увидеть взаимосвязь между строением и свойствами вещества, а также объяснять множество физико-химических явлений.
Что такое спаренный электрон?
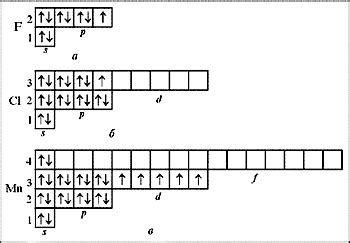
В химии понятие спаренный электрон относится к типу электрона, который находится в атоме в одиночестве, без парного электрона. Спаренные электроны обладают особым поведением и имеют важное значение для химических свойств атомов и молекул.
Спаренный электрон в атоме располагается в одной из электронных областей - орбиталей. Обычно атомы стремятся образовать парные электрона, чтобы выровнять свою энергию. Однако иногда на одной из орбиталей может остаться одиночный или незанятый электрон, который называется спаренным электроном.
Спаренные электроны играют важную роль в химических реакциях и связываются с другими атомами, чтобы образовать химические связи. Они могут участвовать в обмене или переносе электронов, а также взаимодействовать со свободными радикалами и другими частицами. Из-за своей неспаренности эти электроны обладают особыми реакционными свойствами и могут быть реактивными.
Спаренные электроны играют ключевую роль в химических связях и структуре молекул. Их наличие или отсутствие может определять полюсность молекулы и ее химическую активность. Важно учитывать наличие или отсутствие спаренных электронов при изучении свойств различных химических соединений.
Как образуется спаренный электрон?
Спаренный электрон образуется в процессе химических реакций, в которых один электрон из атома или иона получает дополнительный кинетический импульс и переходит на более высокий энергетический уровень. Данный процесс может происходить под воздействием различных факторов, таких как температура, давление, электромагнитное поле и другие.
Когда электрон переходит на более высокий энергетический уровень, он становится подвижным и получает возможность двигаться вокруг ядра атома или иона. В этом состоянии электрон называется спаренным.
Спаренные электроны играют важную роль во многих химических реакциях. Они могут участвовать в обменных реакциях, образуя химические связи с другими атомами или ионами. Кроме того, спаренные электроны могут принимать участие в процессах ионизации и испускания света.
В химии спаренные электроны часто обозначают с помощью стрелки вверх (↑) или просто добавляют символ "+", чтобы указать на их наличие на более высоком энергетическом уровне.
Свойства спаренного электрона
1. Магнитные свойства: Спаренные электроны имеют противоположные ориентации спинового момента, что приводит к тому, что их магнитные моменты складываются и компенсируют друг друга. В результате спаренные электроны не обладают магнитным моментом и не взаимодействуют с внешним магнитным полем.
2. Реактивность: Спаренные электроны значительно менее реактивны, чем непарные электроны. Это связано с тем, что спаренный электрон уже находится в области высокой энергии, и для его участия в химической реакции требуется значительно большая энергия.
3. Взаимодействие с другими электронами: Спаренные электроны оказывают влияние на орбитальное распределение других электронов в атоме и формирование связей. Они создают электронную оболочку более плотной структуры, что способствует повышению стабильности атома и его ионов.
4. Поляризация: Спаренные электроны могут быть поляризованы в сильных электрических полях. В результате спаренные электроны изменяют свою ориентацию спинового момента, что влияет на их магнитные свойства и может вызывать эффекты, связанные с магнитной поляризацией.
| Свойство | Описание |
|---|---|
| Магнитные свойства | Спаренные электроны не обладают магнитным моментом |
| Реактивность | Спаренные электроны менее реактивны |
| Взаимодействие с другими электронами | Спаренные электроны влияют на оболочку и связи атома |
| Поляризация | Спаренные электроны могут быть поляризованы |
Роль спаренного электрона в химии
Спаренные электроны играют важную роль в химических связях и реакциях. Они могут быть разделены при образовании химической связи между атомами, а также участвуют в образовании связей внутри одного атома. Например, в молекулах кислорода (O2) каждый атом кислорода имеет два спаренных электрона, которые образуют сильную связь между атомами.
Кроме того, спаренные электроны могут участвовать в химических реакциях, образуя связи с другими атомами или ионами. Они могут быть переданы от одного атома к другому и участвовать в образовании ионных связей. Например, в химической реакции образования натрия хлорида (NaCl) электрон от атома натрия передается на атом хлора, образуя хлоридный ион, а спаренный электрон с атома натрия становится свободным.
Спаренные электроны также определяют структуру молекул и их свойства. Они влияют на форму и углы между атомами, а также на полярность молекулы. Например, вода (H2O) имеет углы между атомами водорода и кислорода, определенные наличием спаренного электрона на атоме кислорода.
Таким образом, спаренные электроны играют важную роль в формировании химических связей, определении структуры молекул и их свойств. Понимание их роли помогает в понимании и объяснении различных химических явлений и реакций.
Применение спаренного электрона в научных исследованиях

Спаренный электрон, также известный как непогашенный электронный парамагнитный резонанс (EPR), играет важную роль в научных исследованиях в области химии. Этот физический метод позволяет исследователям изучать свойства и структуру различных химических соединений.
Одним из основных применений спаренного электрона является определение структур радикалов. Радикалы - это нестабильные частицы, которые имеют неспаренные электроны. Спаренный электрон позволяет исследователям получать информацию о структуре и динамике радикалов, что является важным шагом в понимании химических реакций и физических свойств соединений.
Кроме того, спаренный электрон используется для исследования магнитных свойств различных материалов. Этот метод позволяет изучать магнитные центры, которые могут быть связаны с ферромагнетизмом, антиферромагнетизмом или другими магнитными явлениями. Понимание магнитных свойств материалов имеет большое значение для разработки новых технологий и материалов.
Также, спаренный электрон используется для изучения электронных переходов и реакций восстановления в различных химических системах. Этот метод позволяет исследователям изучать процессы окисления и восстановления молекул, что важно для понимания химических превращений в природе и разработки новых катализаторов.
Спаренный электрон является мощным инструментом в научных исследованиях, позволяющим получать информацию о структуре, свойствах и реакциях химических соединений. Благодаря этому методу, исследователи могут лучше понять молекулярные процессы и использовать полученные знания для разработки новых материалов и технологий.








