Химические реакции - это процессы, которые происходят между веществами и приводят к образованию новых веществ. Они являются основой химии и играют важную роль в нашей повседневной жизни. Химические реакции могут быть классифицированы по различным признакам, таким как виды взаимодействующих веществ, изменение энергии и изменение состояния веществ. Классификация химических реакций позволяет упорядочить и систематизировать их, делая их понятными и доступными для изучения.
Существует несколько основных типов химических реакций. Одним из них является реакция синтеза, когда два или более простых вещества соединяются, образуя одно более сложное вещество. Это типичная реакция, которая приводит к росту и развитию органических и неорганических структур.
Другим типом реакции является реакция распада, при которой сложное вещество распадается на два или более простых вещества. Это обратный процесс реакции синтеза и может происходить под воздействием тепла, света или другого физического или химического воздействия.
Реакция замещения - третий тип химической реакции, при которой один элемент замещается другим в составе вещества. Замещение может происходить в разных формах, таких как одинаковых зарядов ионов или разных зарядов ионов, в зависимости от химической реакции.
Определение химических реакций: что это такое и зачем они нужны
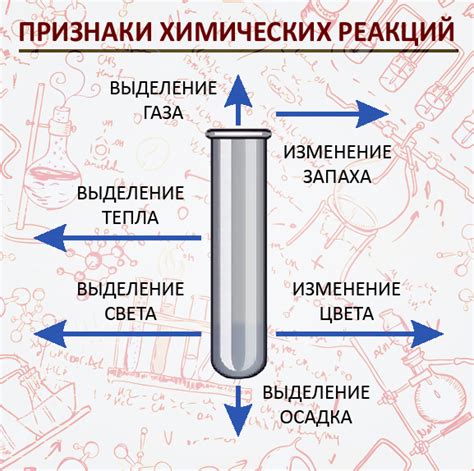
Химические реакции играют важную роль в нашей повседневной жизни и во множестве областей. Они позволяют создавать новые соединения, производить различные продукты, включая медицинские препараты и материалы для строительства. Благодаря химическим реакциям мы можем получать энергию, например, при использовании горючих веществ в автомобилях или при горении древесины в печах.
Химические реакции также позволяют понять и объяснить множество явлений, происходящих в природе, включая процессы, происходящие в организмах живых существ. Благодаря химическим реакциям мы можем разрабатывать новые материалы, улучшать производственные процессы, а также более глубоко понимать и исследовать мир вокруг нас.
Понимание химических реакций и их классификация помогает химикам и ученым разрабатывать новые методы и материалы, а также улучшать процессы производства. Это также позволяет предсказывать свойства новых веществ и разрабатывать новые способы их применения. Классификация химических реакций позволяет упорядочить и систематизировать их, что упрощает изучение данного предмета и обмен информацией между учеными.
Фотохимические реакции: их особенности и роль в природе
Одной из особенностей фотохимических реакций является то, что они происходят только в присутствии света. Фотон, являющийся элементарной частицей света, поглощается атомами или молекулами реагентов и вызывает изменения в структуре и связях между атомами.
Фотохимические реакции играют важную роль в фотосинтезе – процессе, при котором зеленые растения используют энергию света для превращения углекислого газа и воды в органические соединения, такие как глюкоза. Благодаря фотохимическим реакциям, растения вырабатывают кислород и органические вещества, необходимые для жизни других организмов.
Кроме того, фотохимические реакции влияют на состав атмосферы и экологию Земли. Например, фотохимические процессы участвуют в образовании и разложении атмосферного озона. Фотохимический синтез озона осуществляется в стратосфере при участии ультрафиолетового излучения от Солнца. Озон служит естественным фильтром, который поглощает опасное ультрафиолетовое излучение, охраняя живые организмы от вредных его эффектов.
В заключение, фотохимические реакции представляют собой важный класс химических превращений, происходящих при воздействии света. Они играют центральную роль в жизни нашей планеты, включая процессы питания растений и регуляцию состава атмосферы.
Термические реакции: принципы протекания и применение в промышленности

Принципы протекания термических реакций основаны на законах термодинамики и кинетике реакций. Термодинамика определяет энергетическую сторону реакций, тогда как кинетика изучает скорость и механизм протекания реакций.
Термические реакции играют важную роль в промышленности. Они могут применяться для различных целей, включая:
- Синтез веществ: Тепловое воздействие может использоваться для синтеза различных химических соединений. Примером такой реакции может служить получение аммиака, который используется в производстве удобрений и пластмасс.
- Разложение веществ: Высокие температуры могут быть использованы для разложения сложных соединений на более простые компоненты. Например, термическое разложение угля в процессе газификации может привести к образованию синтез-газа, который может быть использован в качестве источника энергии.
- Переработка материалов: Термические реакции могут быть использованы для модификации и переработки материалов. Примером такой реакции может служить обжиг керамики, который обеспечивает ей прочность и устойчивость к воздействию высоких температур.
В промышленности термические реакции часто осуществляются при контролируемых условиях, чтобы обеспечить высокую производительность и качество конечных продуктов. Технические системы, такие как печи и реакторы, позволяют поддерживать оптимальные температуры и давления для проведения термических реакций.
Использование термических реакций в промышленности позволяет получать различные продукты и материалы, которые находят широкое применение в жизни и экономике. Понимание принципов их протекания и возможность контролировать условия реакции являются ключевыми факторами для эффективной реализации процессов и получения высококачественной продукции.
Окислительно-восстановительные реакции: механизм и примеры в биологии
Механизм окислительно-восстановительных реакций основан на передаче электронов от вещества, которое окисляется (восстанавливающееся вещество), к веществу, которое восстанавливается (окисляющееся вещество). В процессе окисления одного вещества, другое вещество получает электроны, что приводит к его восстановлению.
Окисление и восстановление могут происходить и в биологических системах. Например, дыхание – это процесс окисления глюкозы в клетках организмов. В результате этой реакции глюкоза окисляется и образуются другие вещества, а энергия сохраняется в виде АТФ, молекулы, которая служит источником энергии для различных процессов в клетках.
Еще одним примером окислительно-восстановительной реакции в биологии является фотосинтез, процесс, при котором зеленые растения превращают солнечную энергию в химическую энергию. Во время фотосинтеза углекислый газ окисляется и превращается в кислород, а вода восстанавливается, образуя глюкозу.
Таким образом, окислительно-восстановительные реакции в биологии играют важную роль в обмене энергией и позволяют живым организмам функционировать.
Гидролитические реакции: применение в производстве и в живых организмах

В производстве гидролитические реакции используются, например, для получения различных кислот. Они могут быть использованы для синтеза соляной кислоты, серной кислоты, азотной кислоты и других важных химических веществ. Гидролитические реакции также используются для получения оснований, таких как гидроксид натрия или гидроксид кальция.
В живых организмах гидролитические реакции играют ключевую роль во многих процессах. Они позволяют разрушать макромолекулы на более простые компоненты, что необходимо для пищеварения. Например, пищеварительные ферменты гидролизуют полисахариды, белки и липиды на моносахариды, аминокислоты и жирные кислоты, которые могут быть поглощены организмом.
Гидролитические реакции также участвуют в других биохимических процессах, например, в синтезе нуклеиновых кислот или в разрушении простейших веществ, таких как АТФ (аденозинтрифосфат), основного источника энергии в клетках. Большинство ферментативных реакций, происходящих в организмах, основаны на гидролизе или синтезе химических связей.
Таким образом, гидролитические реакции имеют широкое применение как в промышленности, так и в живых организмах. Они играют важную роль в получении химических веществ и обеспечивают правильное функционирование клеток и организмов в целом.
Комплексообразование: химическая реакция, лежащая в основе производства лекарств
Центральный металл может быть различным, в зависимости от конкретной реакции и применяемых веществ. Например, такими металлами могут быть железо, цинк, медь, серебро и другие. Лиганды, в свою очередь, это органические или неорганические соединения, которые могут образовывать с центральным металлом комплексы.
Комплексообразование происходит в несколько этапов. На первом этапе происходит сорбция лигандов на поверхности металла, затем происходит образование комплекса – соединение, состоящее из металла и лигандов. Образовавшиеся комплексы могут быть какуридными, т.е. стабильными, так и лабильными – нестабильными, подверженными разрушению.
Применение комплексообразования в производстве лекарств позволяет улучшить их свойства. Например, комплексные соединения, образованные в результате комплексообразования, обладают более высокой растворимостью, что приводит к повышению их усвояемости организмом. Кроме того, комплексы могут обладать специфическими свойствами, такими как антимикробная или антивирусная активность, благодаря которым они могут использоваться в качестве активных ингредиентов лекарственных препаратов.
Таким образом, комплексообразование является важной реакцией, лежащей в основе производства лекарств. Оно позволяет улучшить свойства лекарственных препаратов и создать более эффективные и безопасные средства для лечения различных заболеваний.
Кислотно-щелочное титрование: роль в аналитической химии и в медицине
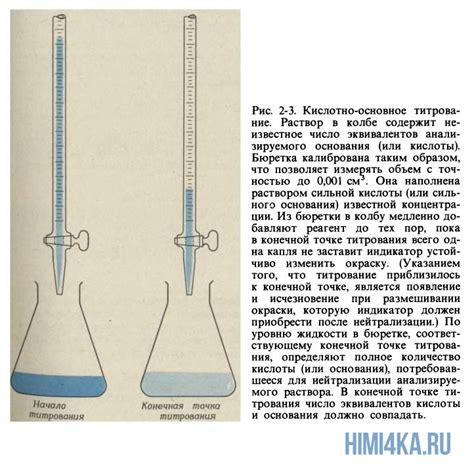
В процессе кислотно-щелочного титрования, известное количество кислоты или основания реагирует с известным количеством щелочи или кислоты соответственно. Определение концентрации реагирующих веществ происходит по объему добавленной реактивной жидкости, необходимой для достижения точки эквивалентности. Таким образом, кислотно-щелочное титрование является количественным методом определения концентрации химических веществ.
Кислотно-щелочное титрование широко применяется в аналитической химии для определения концентрации различных соединений. Например, оно может быть использовано для измерения концентрации кислот или оснований в растворах, определения концентрации солей и других химических веществ в промышленных процессах, контроля качества продуктов питания, фармацевтических препаратов и т.д.
Кроме того, кислотно-щелочное титрование имеет также важное значение в медицине. Оно может быть использовано для определения pH-уровня в крови и других биологических жидкостях. pH-уровень является одним из основных показателей кислотно-щелочного баланса организма. Изменение pH-уровня может свидетельствовать о нарушениях в работе органов и систем организма, а также о прогрессии определенных заболеваний. Поэтому, кислотно-щелочное титрование может быть использовано в медицине для диагностики и мониторинга различных состояний пациента.








