Атом электрона - это основная единица структуры вещества, которая состоит из трех элементарных частиц: протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре атома, в то время как электроны обращаются по своим орбитам вокруг ядра. Именно электроны определяют химические свойства элементов и их взаимодействие.
Атом электрона имеет некий размер и массу, однако большая часть его объема занимается электронной оболочкой, тогда как ядро занимает лишь малую долю пространства. Количественные характеристики атома, такие как его радиус, масса и заряд, являются основными параметрами, которые определяют его поведение и химические свойства.
Одной из ключевых особенностей атома электрона является его электронная структура. Электроны располагаются на орбиталях, которые могут быть представлены в виде энергетических уровней. Каждая орбиталь может содержать определенное количество электронов. Например, уровень "s" может вместить 2 электрона, уровень "p" - 6 электронов, а уровень "d" - 10 электронов. Благодаря этой структуре атома возможно образование электронных облаков и электронных пар, что определяет его реактивность и химическую активность.
Именно изучение атомов электрона позволяет нам понять основы химии и определить свойства веществ. Понимание электронной структуры атома открывает двери для развития новых материалов, лекарств и технологий. Чтобы полностью понять природу атома, необходимо изучить его строение и взаимодействие элементарных частиц. Только тогда можно будет раскрыть все его тайны и получить новые возможности в науке и технике.
Структура атома электрона
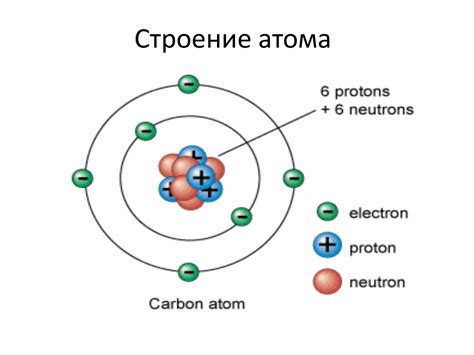
Атом электрона состоит из центрального ядра, вокруг которого движутся электроны. Ядро атома состоит из частиц нейтронов и протонов, которые имеют положительный заряд. Масса ядра концентрируется в протонах и нейтронах, в то время как электроны имеют малую массу и отрицательный заряд.
Количество протонов в ядре определяет атомный номер элемента. На их количество также должно быть равно количеству электронов, чтобы обеспечить нейтральность атома.
Электроны движутся по энергетическим уровням, которые представляют собой орбиты или оболочки вокруг ядра. Первая оболочка находится ближе всего к ядру и может содержать до 2 электронов, вторая оболочка может содержать до 8 электронов, третья - до 18 электронов и так далее.
| Оболочка | Максимальное количество электронов |
|---|---|
| 1 | 2 |
| 2 | 8 |
| 3 | 18 |
Электроны, находящиеся на более близких оболочках, обладают более низкой энергией, чем электроны на более дальних оболочках. Энергетические уровни образуют различные подуровни, которые обозначаются буквами s, p, d, f.
Электроны могут перемещаться с одной оболочки на другую, поглощая или испуская энергию в процессе. Этот процесс является основой для понимания атомной структуры и взаимодействия атомов в химических реакциях.
Химические свойства атома электрона
1. Валентность. Атом электрона имеет устойчивую электронную конфигурацию, в которой заполнены все энергетические уровни. Это позволяет атому электрона образовывать химические связи и вступать в реакции с другими атомами. Валентность атома электрона определяется числом электронов на его внешнем энергетическом уровне.
2. Реактивность. Атомы электрона обладают высокой реактивностью из-за их электронной конфигурации. Они стремятся заполнить свои внешние энергетические уровни или освободить свободные электроны для достижения более устойчивого состояния. Это делает атомы электрона важными участниками в различных химических реакциях.
3. Электроотрицательность. Атомы электрона обладают различной электроотрицательностью, что определяет их способность притягивать или отталкивать электроны в химических реакциях. Более электроотрицательные атомы электрона имеют большую способность притягивать электроны и образовывать ковалентные связи.
4. Ионизационная энергия. Атомы электрона требуют определенной энергии, чтобы удалить один или несколько электронов. Эта энергия называется ионизационной энергией. Ионизационная энергия атома электрона определяет его способность образовывать ионы и взаимодействовать с другими атомами.
5. Аффинность к электрону. Атомы электрона могут также иметь аффинность к электрону, что означает их способность притягивать дополнительные электроны. Аффинность к электрону может быть положительной или отрицательной и влияет на химические реакции и свойства атомов электрона.
Изучение химических свойств атома электрона позволяет понять его важность для химических реакций и образования различных химических соединений.
Квантовая механика и атом электрона

Основные особенности атома электрона в квантовой механике:
- Энергетические уровни: электрон в атоме может занимать только определенные энергетические уровни, которые характеризуются дискретными значениями энергии.
- Квантовые состояния: электрон может находиться в определенном квантовом состоянии, которое описывается волновой функцией.
- Вероятностная интерпретация: квантовая механика описывает состояние электрона в терминах вероятностей, что отличается от классической физики, где состояние частицы задается точно.
- Квантовые скачки: при переходе электрона между квантовыми состояниями происходят квантовые переходы, сопровождающиеся поглощением или испусканием энергии в форме фотонов.
Изучение атома электрона в квантовой механике позволяет понять его поведение и взаимодействие с другими частицами в микромире, и открыть новые горизонты в физике и науке в целом.
Электронные оболочки атома электрона
Первая электронная оболочка наименее удалена от ядра и может вмещать максимум 2 электрона. Вторая и третья электронные оболочки расположены дальше от ядра и могут вмещать соответственно до 8 и до 18 электронов. Следующие электронные оболочки имеют больший радиус и могут вмещать еще больше электронов.
Наиболее удаленная от ядра электронная оболочка называется внешней. Электроны на внешней оболочке называются валентными электронами и играют ключевую роль в химических связях атома. Количество валентных электронов может быть равным номеру группы, в которой находится элемент в периодической системе Менделеева. Так, восьмая группа содержит элементы с восьмью валентными электронами, что является наиболее стабильным состоянием атома.
Взаимодействие атомов электрона
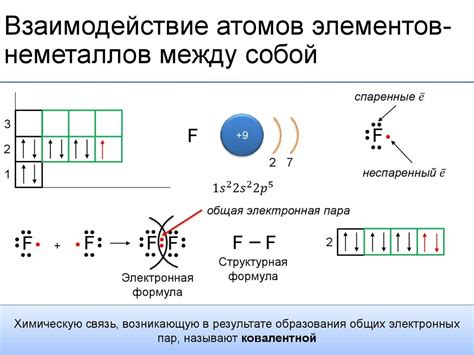
Существуют различные типы химических связей между атомами электрона: ионная, ковалентная и металлическая. В случае ионной связи, один атом электрона отдает электрон другому атому, образуя положительный и отрицательный ион. В случае ковалентной связи, электроны обоих атомов электрона образуют общую область с высокой плотностью электронов. В случае металлической связи, электроны не принадлежат ни одному конкретному атому электрона, а свободно перемещаются по всему металлическому материалу.
Взаимодействие атомов электрона играет ключевую роль во многих аспектах химии и физики. Оно определяет химические реакции, свойства веществ и их состав. Понимание и изучение взаимодействия атомов электрона позволяет разрабатывать новые материалы, лекарства, экологически чистые технологии и многое другое.
Практическое применение атомов электрона
Атомы электрона имеют широкое практическое применение в различных областях науки и техники. Они играют важную роль в таких сферах как электроника, квантовые вычисления и физика материалов.
В электронике атомы электрона используются для создания полупроводниковых элементов, таких как транзисторы, диоды и интегральные схемы. Атомы электрона, размещенные в полупроводнике, образуют зону проводимости и валентную зону, что позволяет управлять потоком электричества и создавать различные электронные устройства.
Квантовые вычисления - это область информатики, основанная на использовании свойств атомов электрона. Атомы электрона могут использоваться для создания кубитов, которые могут быть как 0, так и 1 одновременно благодаря явлению квантовой суперпозиции. Это позволяет выполнять вычисления намного быстрее, чем с использованием классических компьютерных битов.
Физика материалов изучает свойства различных материалов на атомном уровне. Атомы электрона являются основными строительными блоками многих материалов, и их взаимодействие определяет множество свойств материалов, таких как проводимость, прозрачность, магнитные и оптические свойства. Понимание атомного уровня структуры и взаимодействия атомов электрона позволяет разрабатывать новые материалы с желаемыми свойствами.
Таким образом, атомы электрона играют важную роль в современной науке и технике, и их практическое применение включает в себя создание электронных устройств, развитие квантовых вычислений и изучение свойств материалов.








