В химии общая электронная пара является одним из фундаментальных понятий, которое играет важную роль в объяснении химических связей и реакций. Общая электронная пара представляет собой пару электронов, которая участвует в образовании химической связи между атомами в молекуле. Эта пара электронов может быть общей для двух атомов или распределенной между более чем двумя атомами.
Роль общей электронной пары в химических реакциях заключается в том, что она может быть перемещена от одного атома к другому. Этот процесс, известный как реакция передачи электрона или окислительно-восстановительная реакция, играет ключевую роль в реакциях окисления и восстановления. Во время такой реакции, один атом получает электрон, становясь восстановленным, а другой атом теряет электрон, становясь окисленным.
Общая электронная пара также может быть использована для образования ковалентных связей в молекулах. Ковалентная связь формируется, когда два атома делят пару электронов. Каждый атом в молекуле вносит свою общую электронную пару, образуя таким образом сильную связь, которая удерживает их вместе.
Понимание значения общей электронной пары в химии позволяет ученым предсказывать химические связи и реакции, а также исследовать свойства и структуру молекул. Она является основой молекулярной геометрии, обуславливая форму молекул и их свойства.
Общая электронная пара
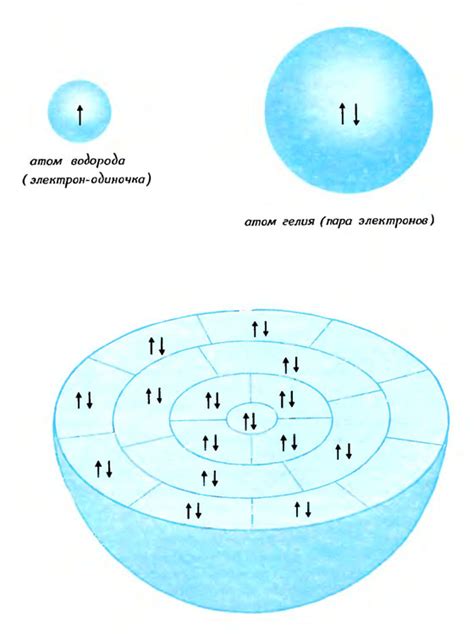
Общая электронная пара является ключевым понятием в молекулярной и органической химии, поскольку она определяет характер связей и стабильность молекул. Общая электронная пара может быть связана с одним атомом (как водородная связь) или разделена между двумя атомами (как в ковалентной связи).
Роль общей электронной пары в химических реакциях заключается в создании связей между атомами или разрыве существующих связей. ОЭП может быть участвовать в реакциях, образуя новые химические соединения или участвуя в процессе обмена электронами.
| Тип связи | Пример |
|---|---|
| Ковалентная связь | Молекула воды (H2O) |
| Координатная (донор-акцептор) | Комплекс металл-лиганд |
| Ионная связь | Хлорид натрия (NaCl) |
Значение общей электронной пары
Общая электронная пара играет важную роль в химических реакциях. Она может быть разделяемой между атомами, образуя полярную связь, или быть не разделяемой, образуя неполярную связь.
Полярная связь образуется, когда один атом в молекуле притягивает общую электронную пару сильнее, чем другой. Это приводит к разделению заряда в молекуле, где один атом получает частично положительный заряд, а другой - частично отрицательный заряд.
Неполярная связь образуется, когда оба атома в молекуле одинаково притягивают общую электронную пару и не происходит разделения заряда.
Общая электронная пара также может быть участвующей или невовлеченной в химическую реакцию. Участвующая электронная пара принимает участие в образовании новых химических связей, тогда как невовлеченная электронная пара не принимает участия в реакции и остается свободной.
Таким образом, общая электронная пара является основным строительным блоком молекул и играет важную роль в определении их свойств и поведения в химических реакциях.
Роль общей электронной пары в химических реакциях

ОЭП может образовываться при обмене электронами между атомами или ионами в процессе химических реакций. При этом один атом или ион предоставляет пару электронов, чтобы она стала общей для обоих частиц, что приводит к образованию химической связи.
Общая электронная пара играет важную роль в определении структуры молекулы. Она может быть причиной образования различных типов химических связей, таких как ковалентная связь, координатная связь или ионная связь.
Кроме того, ОЭП может принимать участие в химических реакциях, перенося электроны от одного атома или иона к другому. Это может приводить к изменению степени окисления атомов и ионов, что может быть важным для процесса окисления-восстановления.
В заключение, общая электронная пара играет ключевую роль в химических реакциях, обеспечивая стабильность химических соединений и участвуя в образовании химических связей. Также, она может участвовать в переносе электронов в процессе реакций. Понимание роли ОЭП позволяет более глубоко понять механизмы химических реакций и строение молекул.
Восстановление и окисление в химии
Окисление - это процесс потери электронов, когда атом или ион становится более положительно заряженным. Восстановление, напротив, - это процесс получения электронов, при котором атом или ион становится более отрицательно заряженным.
Восстановление и окисление можно представить как обмен электронами между атомами разных веществ. Восстановление и окисление происходят параллельно друг другу, и один процесс не может происходить без другого. Соответственно, восстановитель всегда сопровождается окислителем и наоборот.
Восстановитель - это вещество, способное отдавать электроны, становясь при этом окисленным. Окислитель - это вещество, способное принимать электроны, становясь при этом восстановленным. Во время химической реакции, восстановитель увеличивается в степени окисления, а окислитель уменьшается.
Окисление и восстановление играют важную роль во многих химических процессах. Они применяются в электрохимии, органическом синтезе, каталитических реакциях и других областях химии.
| Примеры окислений | Примеры восстановлений |
|---|---|
| 2Ag + Cu2+ → 2Ag+ + Cu | Fe2+ + Sn4+ → Fe3+ + Sn2+ |
| 2Mg + O2 → 2MgO | Cu2+ + 2e- → Cu |
| 2Na + Cl2 → 2NaCl | 2H+ + 2e- → H2 |
Электрофильные и нуклеофильные реакции

В химии существует два основных типа реакций, в которых участвуют общие электронные пары: электрофильные реакции и нуклеофильные реакции.
Электрофильные реакции происходят при взаимодействии электрофилов и нуклеофилов. Электрофилы – это вещества, способные принимать общую электронную пару. Они являются электронно дефицитными и обладают положительным зарядом или производные от них. Нуклеофилы, в свою очередь, являются веществами, способными предоставить общую электронную пару для образования новой химической связи. Они обладают отрицательным зарядом или содержат атомы с несвязанными парами электронов.
В электрофильных реакциях электрофил атакует нуклеофил, что приводит к образованию новой химической связи. Примером электрофильной реакции может служить алкилирование, в котором электрофильный карбокатион реагирует с нуклеофильным атомом.
Нуклеофильные реакции, наоборот, происходят при взаимодействии нуклеофилов и электрофилов. В них нуклеофиль дает пару электронов электрофилу, образуя новую химическую связь. Примером нуклеофильной реакции является реакция замещения, где нуклеофиль замещает другую группу в органическом соединении.
Важно отметить, что электрофильные и нуклеофильные реакции являются взаимозависимыми и взаимно дополняют друг друга. Они играют важную роль в химии, позволяя образовывать новые соединения и изменять их структуру.
Примеры реакций с участием общей электронной пары
Ниже приведены некоторые примеры реакций с участием общей электронной пары:
Образование воды (H2O) из молекул водорода (H2) и кислорода (O2):
- 2H2 + O2 → 2H2O
Образование метана (CH4) из молекул метанола (CH3OH) и водорода (H2):
- CH3OH + 2H2 → CH4 + H2O
Образование этилена (C2H4) из молекул этана (C2H6):
- C2H6 → C2H4 + H2
В каждом из этих примеров общая электронная пара играет ключевую роль в образовании новых химических связей между атомами. Это позволяет молекулам образовываться, разрушаться или претерпевать другие изменения в процессе химических реакций.








