Наивысшая степень окисления - это значение окислительно-восстановительной способности элемента или соединения. Она указывает на самую высокую возможную степень окисления для данного вещества. Определение наивысшей степени окисления является важной задачей в химии, поскольку позволяет определить химическую активность вещества и его способность участвовать в химических реакциях.
Наивысшая степень окисления определяется путем анализа структуры вещества и электронной конфигурации атома. Окисление - это процесс, при котором атом или ион теряет электроны, а восстановление - это процесс, при котором атом или ион получает электроны. Значение наивысшей степени окисления можно определить на основе числа электронов, которые атом должен получить или отдать, чтобы достичь стабильной октаэдрической конфигурации.
Например, водород воды (H2O) имеет наивысшую степень окисления +1, поскольку он должен отдать один электрон, чтобы достичь стабильной октаэдрической конфигурации. Кислород в воде имеет наивысшую степень окисления -2, поскольку он должен получить два электрона для достижения стабильной октаэдрической конфигурации. Таким образом, вода имеет общую степень окисления 0, так как сумма степеней окисления всех элементов должна быть равна нулю.
Знание наивысшей степени окисления позволяет определить тип химических связей и реакций, а также прогнозировать реакционную способность вещества. Оно также является важным при проведении анализа различных химических процессов и реакций. Понимание наивысшей степени окисления помогает ученым и инженерам работать с веществами с высоким содержанием энергии или вредных химических соединений и принимать соответствующие меры безопасности.
Что такое наивысшая степень окисления?
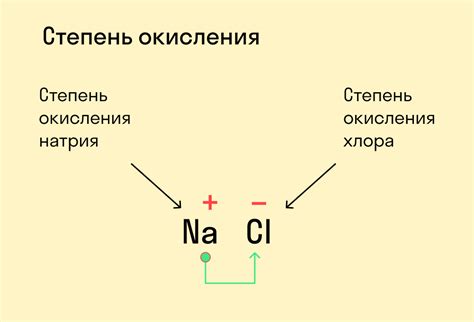
Наивысшая степень окисления может быть положительной, отрицательной или равной нулю. Она определяется исходя из электроотрицательности элемента и правил расчета степени окисления.
Наивысшая степень окисления может быть полезна для определения химической активности элемента, его окислительных или восстановительных свойств. Она также может быть использована для предсказания смены степени окисления во время химических реакций.
Например, в соединении H2O, наивысшая степень окисления кислорода равна -2, так как он обычно принимает два электрона от водорода.
Определение и принципы определения наивысшей степени окисления
Определение наивысшей степени окисления может быть выполнено с помощью ряда правил и принципов:
- Элементарное вещество: в данном случае, наивысшая степень окисления элемента будет равна нулю.
- Простые ионы: наивысшая степень окисления равна заряду иона (например, для Na+ наивысшая степень окисления равна +1).
- Окислительно-восстановительные свойства: наивысшая степень окисления будет равна заряду элемента, если он выступает в качестве окислителя или восстановителя (например, Mn в MnO4- имеет наивысшую степень окисления +7).
- Условия структурного фактора: в некоторых соединениях степень окисления элемента может быть определена исходя из структурных факторов (например, в H2O, кислород имеет наивысшую степень окисления -2).
Определение наивысшей степени окисления является важным инструментом при решении различных химических задач и позволяет лучше понять характер и свойства вещества.
Как определить наивысшую степень окисления в соединении
Для определения наивысшей степени окисления в соединении следует учитывать общую электроотрицательность элемента. Чем более электроотрицательный элемент, тем выше его степень окисления.
1. Наивысшая степень окисления обычно приходится на элемент с самой высокой электроотрицательностью. Например, в соединении H2O (вода) кислород является самым электроотрицательным элементом, поэтому его степень окисления равна -2, а для водорода степень окисления будет +1.
2. Если все элементы в соединении имеют одинаковую электроотрицательность, их степень окисления будет равна нулю. Например, в молекуле Cl2 (дихлор) оба атома хлора имеют одинаковую электроотрицательность, поэтому их степень окисления равна нулю.
3. Если электроотрицательность различается, но вещество является ионом или ионной формой, степень окисления каждого элемента равна заряду иона. Например, в ионе NH4+ степень окисления азота равна -3, а для водорода степень окисления будет +1.
Важно помнить, что указание наивысшей степени окисления возможно только при изучении конкретного соединения и требует знания электроотрицательности элементов и правил определения степеней окисления.
Понятие окислительно-восстановительных реакций
ОВР играют важную роль в жизнедеятельности организмов. Процессы дыхания и питания в клетках организмов связаны с окислительно-восстановительными реакциями. Например, в реакции дыхания глюкозы в организме человека, кислород восстанавливается (получает электроны), а глюкоза окисляется (отдает электроны).
ОВР также широко применяются в промышленности и химическом производстве. Например, в процессе производства алюминия методом электролиза происходит окислительно-восстановительная реакция, где оксид алюминия восстанавливается до металлического алюминия.
Ключевыми понятиями, связанными с ОВР, являются окислитель и восстановитель. Окислитель – это вещество, способное принимать электроны и при этом само восстановиться. Восстановитель – это вещество, способное отдавать электроны и при этом само окисляться.
Важно знать, что в окислительно-восстановительных реакциях всегда присутствуют как окислители, так и восстановители. Окислитель и восстановитель образуют так называемую окислительно-восстановительную пару, где окислитель и восстановитель являются соответствующими ионами или молекулами.
Окислительно-восстановительные реакции представляют собой важный аспект химических процессов и имеют большое значение в различных областях науки и технологий.
Значение наивысшей степени окисления в химии

Наивысшая степень окисления обозначается числом и может быть положительной или отрицательной. Положительная степень окисления означает, что атом потерял электроны, а отрицательная степень окисления указывает на то, что атом получил дополнительные электроны.
Зная значениe наивысшей степени окисления, можно определить молекулярную формулу соединения и даже предсказать возможные реакции, которые могут произойти между различными веществами. Это позволяет более глубоко изучать и понимать процессы, происходящие в химических реакциях, и применять полученные знания в практических задачах.
Примером наивысшей степени окисления может служить водородный ион (H+), имеющий степень окисления +1, а также кислородный ион (O2-), имеющий степень окисления -2. Знание данных значений является важным при работе с различными соединениями и при проведении химических расчетов.
Исторический обзор изучения наивысшей степени окисления
Изучение наивысшей степени окисления началось в XIX веке, когда было обнаружено, что вещества могут образовывать различные соединения с разными степенями окисления. Одним из первых ученых, который занимался изучением этого феномена, был шведский химик Йенс Берселиус.
Берселиус провел множество экспериментов и сформулировал базовые принципы определения степени окисления веществ. Он разработал систему обозначений, в которой полагал, что все элементы имеют определенную максимальную степень окисления. Затем он определил степень окисления для нескольких элементов, таких как кислород и водород.
В последующие годы исследователи продолжали изучать наивысшую степень окисления и выявлять новые паттерны и закономерности. Было обнаружено, что степень окисления может быть представлена в виде ряда чисел для каждого элемента, и что она связана с электронной структурой атома. Были разработаны более сложные модели и теории, которые позволили лучше понять, как степень окисления влияет на химические свойства веществ.
Сегодня изучение наивысшей степени окисления является важной частью химии и помогает химикам анализировать и прогнозировать взаимодействие веществ. Оно также имеет практическое применение в различных областях науки и технологий, таких как катализ и электрохимия.
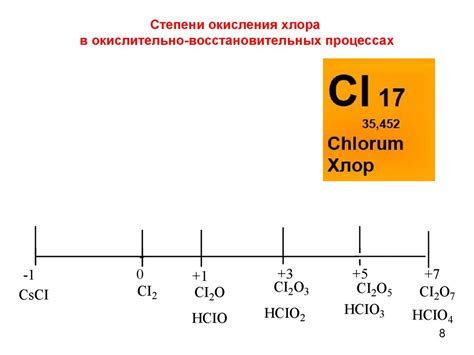
Примеры наивысшей степени окисления в неорганических соединениях

Марганец (V) оксид (Mn2O7)
Марганец (V) оксид является наивысшей степенью окисления марганца в неорганических соединениях. В молекуле Mn2O7 каждый атом марганца имеет степень окисления +7.
Хлортрифторид (ClF3)
Хлортрифторид представляет собой соединение, в котором хлор и фтор имеют наивысшую степень окисления. В молекуле ClF3 атом хлора имеет степень окисления +3, а атом фтора – степень окисления -1.
Перекись водорода (H2O2)
Перекись водорода – это соединение, в котором атомы водорода имеют степень окисления +1, а атомы кислорода – степень окисления -1. Степень окисления кислорода в перекиси водорода является наивысшей в неорганических соединениях и составляет -1.
Примеры наивысшей степени окисления в органических соединениях
Наивысшая степень окисления в органических соединениях соответствует наибольшему возможному количеству электронов, которые могут перенести атомы азота, кислорода или галогенов. Здесь перечислены некоторые примеры органических соединений с наивысшей степенью окисления:
Карбоновые кислоты: Карбоновые кислоты содержат функциональную группу карбоксильной кислоты (COOH). Примерами таких кислот являются муравьиная кислота (HCOOH), уксусная кислота (CH3COOH) и бензойная кислота (C6H5COOH). В этих соединениях углерод имеет степень окисления +3.
Эфиры: Эфиры образуются в результате реакции алкоголя с кислородом из карбоновой кислоты. В эфирах кислород имеет степень окисления -2, алкоголь имеет степень окисления -2, а углерод - степень окисления +4. Примером эфира является метанол (CH3OH), в котором метиловый группе присоединен кислородный атом.
Кетоны: Кетоны содержат функциональную группу кетона (C=O), где углерод имеет степень окисления +2, а атом кислорода -2. Примером кетона является ацетон (CH3COCH3), в котором два метильных остатка соединены через атом кислорода.
Альдегиды: Альдегиды содержат функциональную группу альдегида (CHO), где углерод имеет степень окисления +1, а атом кислорода -2. Примером альдегида является формальдегид (CH2O), в котором углерод соединен с атомом водорода и атомом кислорода.
Азиды: Азиды содержат функциональную группу азида (N3-), где атом азота имеет степень окисления +1. Примером азида является натриевый азид (NaN3), который используется в автомобильных подушках безопасности.
Эти примеры представляют лишь небольшую часть органических соединений с наивысшей степенью окисления. В органической химии существует множество других соединений с разными степенями окисления.
Роль наивысшей степени окисления в процессах жизнедеятельности
Наивысшая степень окисления играет важную роль в различных процессах жизнедеятельности. Она связана с изменением электронного состояния атома при окислительно-восстановительных реакциях.
В метаболических процессах организма наивысшая степень окисления используется для получения энергии. Например, в процессе окисления глюкозы в клетках происходит образование углекислого газа и воды с выделением энергии. Основным активным веществом в этом процессе является молекула аденозинтрифосфата (АТФ), которая при окислении превращается в аденозиндифосфат (АДФ) с выделением энергии, которая далее используется клеткой для синтеза необходимых для жизни веществ и поддержания функций организма.
Наивысшая степень окисления также имеет значение в биохимических реакциях, касающихся переноса электронов. Например, в дыхательной цепи, которая происходит в митохондриях клеток, электроны переносятся по цепочке белковых комплексов, причем передвижение электронов сопровождается изменением их степени окисления. Наивысшая степень окисления здесь достигается в молекуле кислорода, куда поступают электроны и которая в конечном итоге превращается в воду.
Важно отметить, что наивысшая степень окисления также может быть связана с возникновением вредных процессов в организме. Например, окислительное стрессовое состояние, при котором происходит усиленное образование свободных радикалов и повреждение клеток, связано с нарушением баланса степеней окисления и восстановления в организме. Поэтому поддержание равновесия между процессами окисления и восстановления является важной задачей для поддержания здоровья и нормальной функции организма.








