В химии существует два основных типа реакций – эндотермические и экзотермические. Эти термины описывают, как изменяется энергия в процессе химической реакции.
Эндотермическая реакция – это реакция, в которой система поглощает энергию из окружающей среды. Во время эндотермической реакции, энергия поглощается, что приводит к увеличению температуры системы. Этот процесс необратим, который требует постоянного энергетического воздействия для продолжения реакции.
Напротив, экзотермическая реакция – это реакция, в результате которой высвобождается энергия в окружающую среду. Во время экзотермической реакции, энергия выделяется в виде тепла, света или звука. Эта реакция самоподдерживающаяся, так как выделение энергии способствует продолжению реакции.
Примеры экзотермических реакций – горение древесины, взрыв динамита и окисление железа. Во всех этих случаях, выделение энергии в результате реакции обуславливает особый эффект – горение, взрыв или окисление.
Примером эндотермической реакции может служить холодный пакет, который активируется нажатием или сотрясением, что позволяет ему поглощать тепло из окружающей среды и охлаждать продукты.
Оба типа реакций имеют важное значение в химии и приложения в различных областях науки и техники.
Эндотермические и экзотермические реакции

В экзотермических реакциях выделяется энергия в виде тепла или света. Энергия, освобождающаяся в процессе реакции, передается окружающей среде. Например, сгорание древесины или топлива в атмосфере является экзотермической реакцией.
В эндотермических реакциях энергия поглощается из окружающей среды. Это значит, что реакция требует поступления энергии для ее проведения. Например, поглощение тепла во время варки воды или фотосинтез растений являются эндотермическими реакциями.
Оба типа реакций играют важную роль во многих процессах, происходящих в природе и в промышленности. Понимание этих типов реакций помогает проектировать новые материалы, разрабатывать эффективные процессы производства и оптимизировать энергетические системы.
Определение эндотермических реакций
В эндотермических реакциях энергия входит в систему в виде тепла, чтобы преобразовать реагенты в продукты. Процесс поглощения тепла обычно возникает при реакциях разрушения химических связей в реагентах и образования новых связей в продуктах.
Некоторые примеры эндотермических реакций включают восстановление кальция из его оксида, распад аммиака на азот и водород, а также испарение жидкости.
Процесс эндотермической реакции понятно, можно проиллюстрировать его с помощью следующего уравнения:
Реагент 1 + Реагент 2 + тепло → Продукт 1 + Продукт 2
Определение экзотермических реакций

В экзотермической реакции, начальная энергия системы выше конечной энергии системы и тепло освобождается в процессе реакции. Тепло может быть выделяться в виде света или звука, но чаще всего это и есть тепло.
Примером экзотермической реакции является горение. Когда огонь горит, окружающая среда нагревается за счет выделяющегося тепла. Реакция окисления горючего вещества с кислородом происходит с выделением энергии в виде тепла и света.
Примеры эндотермических реакций
Примеры эндотермических реакций:
- Восстановление известкового камня: при нагревании известкового камня деоксидирующим агентом, таким как уголь, поглощается тепло.
- Восстановление железной руды: в процессе обогащения железной руды тепло поглощается при использовании оксидирующих агентов, таких как кокс.
- Испарение: при испарении жидкости тепло поглощается из окружающей среды.
- Растворение солей: при растворении солей в воде тепло поглощается, что вызывает охлаждение раствора.
Все эти реакции потребляют энергию и требуют добавления тепла для их совершения, поэтому они являются эндотермическими.
Примеры экзотермических реакций
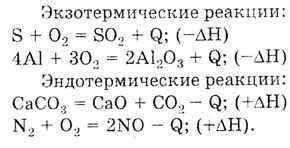
Примеры экзотермических реакций:
| Реакция | Продукты реакции | Выделение тепла |
|---|---|---|
| Горение древесины | Углеродный диоксид и вода | Высвобождение тепла |
| Реакция разложения перекиси водорода | Вода и кислород | Выделение тепла |
| Гидролиз натрия | Гидроксид натрия и водород | Высвобождение тепла |
| Горение бензина | Углеродный диоксид и вода | Выделение тепла |








