Амфотерность означает свойство вещества проявлять как кислотные, так и щелочные свойства. Это явление встречается редко и требует особого внимания при изучении химии. В зависимости от условий вещество может проявлять себя в различных реакциях, что делает его уникальным и интересным для исследования.
Когда вещество взаимодействует с кислотным окружением, оно ведет себя как щелочь, принимая отрицательные ионы водорода. С другой стороны, при взаимодействии с щелочным окружением оно проявляет кислотные свойства, отдавая отрицательные ионы водорода и принимая положительные ионы гидроксида. Такое поведение вещества можно объяснить его структурой и связями между его атомами.
Примером амфотерного вещества является вода. Известно, что она может действовать как кислота, отдавая ионы водорода, и как щелочь, принимая ионы водорода. Это свойство воды делает ее универсальным растворителем и важной составляющей жизни на Земле.
Амфотерный характер также проявляется у других важных веществ, таких как амфотерные оксиды и гидроксиды. Они обладают способностью реагировать как с кислотными, так и с щелочными реагентами. Это свойство используется во многих химических процессах и может быть полезным для понимания причин и последствий различных реакций.
Что такое амфотерный характер?
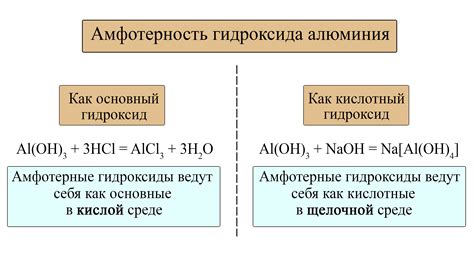
Важно отметить, что амфотерный характер может проявляться только в некоторых условиях, например, в зависимости от рН среды. В кислой среде они ведут себя как базы, а в щелочной среде – как кислоты. Также амфотерное поведение связано с наличием свободных электронных пар или кислородных или азотных атомов в молекуле.
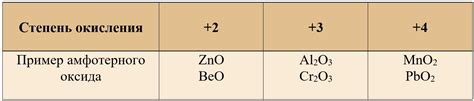
Амфотерные вещества встречаются как в природе, так и синтезируются искусственно. Примерами амфотерных веществ являются оксиды металлов, такие как оксид цинка (ZnO) или оксид алюминия (Al2O3). Также амфотерные свойства проявляют некоторые ионы, например, ионы аммония (NH4+) или гидроксида (OH-).
Амфотерный характер важен в химии, поскольку позволяет веществам взаимодействовать с разными реагентами и в разных условиях. Это свойство часто используется в промышленности и в лабораторных исследованиях для получения различных продуктов и реакций.
| Примеры амфотерных веществ: | Проявление амфотерного характера |
|---|---|
| Оксид цинка (ZnO) | Взаимодействие с кислотами и щелочами |
| Оксид алюминия (Al2O3) | Взаимодействие с кислотами и щелочами |
| Ионы аммония (NH4+) | Взаимодействие с кислотами и щелочами |
| Ионы гидроксида (OH-) | Взаимодействие с кислотами и щелочами |
Определение и основные принципы
Основные принципы амфотеризма включают следующие аспекты:
1. Вещества с амфотерным характером | Определенные вещества имеют амфотерные свойства и способны проявлять себя как кислоты или основания в зависимости от условий окружающей среды. |
2. Ионный обмен | Амфотерные вещества могут образовывать ионные связи как с протонами, так и с гидроксидными ионами. Происходит обмен протонами или между гидроксидными ионами, что определяет кислотные или основные свойства вещества. |
3. Изменение реакционной способности | Амфотерные вещества могут изменять свою реакционную способность в зависимости от окружающей среды и условий реакции. Они могут проявлять кислотные или основные свойства в различных средах и с разными реагентами. |
4. Равновесные реакции | Вещества с амфотерным характером участвуют в равновесных реакциях, где происходит обмен протонами или гидроксидными ионами в зависимости от концентраций и pH раствора. |
Понимание и учет амфотерного характера веществ позволяет разрабатывать более точные и предсказуемые реакции, а также использовать эти свойства для различных промышленных и научных целей.
Как проявляется амфотерный характер?

Амфотерный характер относится к веществам, которые могут проявлять как кислотные, так и основные свойства.
Проявление амфотерного характера может происходить на различных уровнях:
- На уровне молекул. Вещества с амфотерным характером могут принимать ионную форму не только как катионы, но и как анионы, в зависимости от условий окружающей среды.
- На уровне растворов. Когда амфотерное вещество растворяется в воде, оно может проявлять свою кислотную или основную природу в зависимости от pH раствора. Так, например, амфотерный оксид алюминия, Al2O3, в кислой среде проявляет основные свойства, а в щелочной среде - кислотные.
- На уровне реакций. Вещества с амфотерным характером могут вступать в реакции как с кислотами, так и с щелочами. Например, амфотерные оксиды могут образовывать соли при реакции с кислотами, и в то же время, они могут взаимодействовать с щелочами, образуя гидроксиды.
Проявление амфотерного характера у веществ имеет важное значение во многих областях, включая химию, биологию и окружающую среду.
Амфотерные вещества в химии
Как кислоты, амфотерные вещества могут отдавать протоны (водородные ионы H+) в щелочной среде или при взаимодействии с более сильными кислотами. При этом они выступают в роли кислоты, так как отдают свои протоны.
Как основания, амфотерные вещества могут принимать протоны (ведь они обладают свободными электронными парами) от кислоты в кислотной среде или взаимодействовать с более слабыми основаниями. В этом случае они выступают в роли основания, так как принимают протоны.
Примеры амфотерных веществ в химии включают в себя воду (H2O), оксиды некоторых элементов (например, оксид алюминия Al2O3), аминокислоты и некоторые другие органические соединения.
Способность взаимодействовать с кислотами и основаниями делает амфотерные вещества уникальными. Это свойство позволяет им проявлять различные химические реакции и играть важную роль во многих процессах, в том числе в биологии, фармации и промышленности.
Примеры амфотерных веществ
В природе существует ряд веществ, которые обладают амфотерным характером и могут проявлять кислотные или щелочные свойства в зависимости от среды.
Одним из самых известных примеров амфотерных веществ является вода. Вода может действовать как кислота, отдавая протоны, так и как щелочь, принимая протоны. Это происходит при образовании гидроксильных (OH-) и гидроксониевых (H3O+) ионов.
Еще одним примером амфотерного вещества является аминокислота глицин. Глицин может проявлять кислотные свойства, отдавая протоны, а также щелочные свойства, принимая протоны. Это позволяет ему участвовать в различных биохимических процессах в организме.
Также стоит отметить оксиды и гидроксиды многих металлов, которые являются амфотерными веществами. Например, оксид алюминия (Al2O3) может реагировать как с кислотными, так и с щелочными реагентами, образуя соли.
Примером амфотерного вещества может служить также амфотерная глина, которая может проявлять как кислотные, так и щелочные свойства при контакте с различными веществами и реагентами.
Таким образом, амфотерные вещества представляют собой уникальные соединения, которые могут проявляться как кислоты или щелочи в зависимости от условий их взаимодействия с другими веществами.
Роль амфотерных веществ в природе
Амфотерные вещества играют важную роль в природе и встречаются в различных сферах её жизни. Они проявляют свой амфотерный характер взаимодействуя с кислотами и щелочами, способностью образовывать как кислотные, так и щелочные соединения.
В геологических процессах амфотерные вещества, такие как алюминий и железо, используются для образования различных минералов. Например, глины и сланцы представляют собой амфотерные минералы, образованные в результате взаимодействия с кислотами и щелочами в природных условиях.
В биологических системах амфотерные аминокислоты играют важную роль в структуре и функции белков, основных строительных блоков живых организмов. Они способны взаимодействовать с кислотами и щелочами, что позволяет им выполнять различные функции, от регуляции pH среды до катализа реакций.
Амфотерные вещества также имеют применение в промышленности и быту. Например, алюминий используется для производства лёгких и прочных конструкций, а также в процессе обработки пищевых продуктов. Медь, также являющаяся амфотерным элементом, используется в электротехнике и производстве медных изделий.
Таким образом, амфотерные вещества являются важными игроками в природных и промышленных процессах, обладая свойством взаимодействия с кислотами и щелочами, что позволяет им выполнять различные функции и использоваться в разных сферах жизни.








